很多高中生都认为化学学习很难,其实需要高中化学只需要科学的学习方法和认真的学习态度。今天小编在这给大家整理了高二化学知识点总结,接下来随着小编一起来看看吧!
高二化学知识点总结必修四
第二章 化学反应速率与化学平衡
考点1:化学反应速率
1、化学反应速率的表示方法___________。
化学反应速率通常用单位时间内反应物浓度和生成物浓度的变化来表示。表达式:___________ 。
其常用的单位是__________ 、 或__________ 。
2、影响化学反应速率的因素
1)内因(主要因素)
反应物本身的性质。
2)外因(其他条件不变,只改变一个条件)
3、理论解释——有效碰撞理论
(1)活化分子、活化能、有效碰撞
①活化分子:能够发生有效碰撞的分子。
②活化能:如图
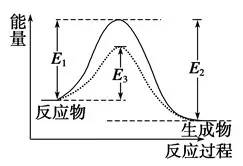
图中:E1为正反应的活化能,使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系
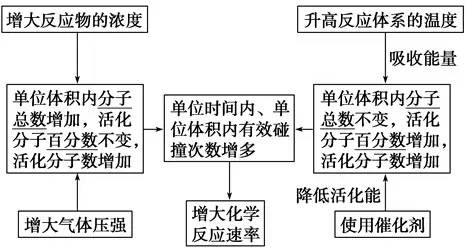
考点2:化学平衡
1、化学平衡状态:一定条件(恒温、恒容或恒压)下的可逆反应里,正反应和逆反应的速率相等,反应混合物(包括反应物和生成物)中各组分的浓度保持不变的状态。
2、化学平衡状态的特征

3、判断化学平衡状态的依据
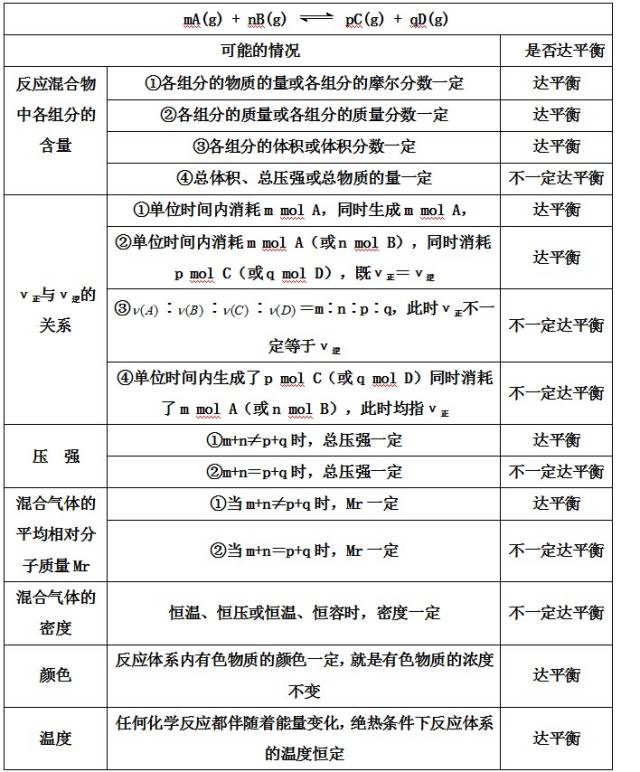
考点3:化学平衡的移动
1、概念
可逆反应中旧化学平衡的破坏、新化学平衡的建立,由原平衡状态向新化学平衡状态的转化过程,称为化学平衡的移动。
2、化学平衡移动与化学反应速率的关系
(1)v正>v逆:平衡向正反应方向移动。
(2)v正=v逆:反应达到平衡状态,不发生平衡移动。
(3)v正<v逆:平衡向逆反应方向移动。< p="">
3、影响化学平衡的因素
4、“惰性气体”对化学平衡的影响
①恒温、恒容条件
原平衡体系体系总压强增大―→体系中各组分的浓度不变―→平衡不移动。
②恒温、恒压条件
原平衡体系容器容积增大,各反应气体的分压减小―→体系中各组分的浓度同倍数减小
5、勒夏特列原理
定义:如果改变影响平衡的一个条件(如C、P或T等),平衡就向能够减弱这种改变的方向移动。
原理适用的范围:已达平衡的体系、所有的平衡状态(如溶解平衡、化学平衡、电离平衡、水解平衡等)和只限于改变影响平衡的一个条件。
勒夏特列原理中“减弱这种改变”的解释:外界条件改变使平衡发生移动的结果,是减弱对这种条件的改变,而不是抵消这种改变,也就是说:外界因素对平衡体系的影响占主要方面。
高二化学学哪几本书?
《选修4:化学反应与原理》
《选修3:物质的结构与性质》
《选修5:有机化学基础》
常考化学常识
材料及成分
1. 火棉:纤维素与硝酸完全酯化的产物;
2. 胶棉:纤维素与硝酸不完全酯化的产物;
3. 人造丝、人造毛、人造棉、黏胶纤维、铜氨纤维主要成分都是纤维素;
4. 醋酸纤维:纤维素与醋酸酐酯化后的产物;
5. 光导纤维:成分为SiO2,全反射原理;
6. Al2O3:人造刚玉、红宝石、蓝宝石的主要成分;
7. SiO2:硅石、玻璃、石英、玛瑙、光纤的主要成分;
8. 硅酸盐:水泥、陶器、瓷器、琉璃的主要成分;
9. 新型无机非金属材料:氧化铝陶瓷、氮化硅陶瓷、碳化硼陶瓷、光纤等;
具有耐高温、强度大的特性,还具有电学特性、光学特性、生物功能;
10. 传统无机非金属材料:水泥、玻璃、陶瓷;
11. 新型高分子材料:高分子膜、尿不湿、隐形眼镜、人造关节、心脏补片、液晶材料等;
12. 三大合成材料:合成塑料、合成纤维、合成橡胶;
高二化学知识点总结第二章相关文章:
★ 高中化学必修一第二章知识点总结
★ 高二化学知识点总结归纳
★ 高二化学复习:重要知识点总结
★ 高二化学知识点整理
★ 人教版 高一化学必修二第2章知识点总结
★ 高中化学选修4知识点总结
★ 高二化学必备的知识点
★ 高一化学必修二知识点总结
★ 高二化学重难点易错知识点汇总与解析
★ 高中化学知识点总结
上一篇:高二化学重要知识点归纳2022






